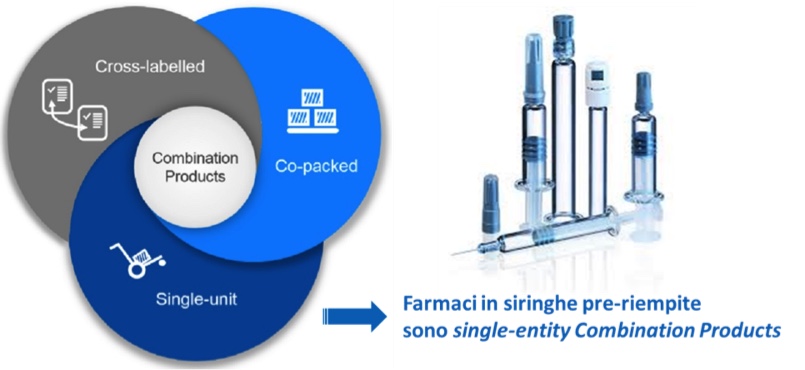
Siringhe pre-riempite (PFS) come esempio di single-entity Combination Product
Le sfide tecnico-regolatorie nel Life-Cycle Management e l’importanza di un prodotto di combinazione che soddisfi i requisiti in termini di qualità, sicurezza e performance
Tra le industrie italiane del settore farmaceutico, Italfarmaco Spa produce nel suo sito di Milano medicinali iniettabili. Lo sviluppo e la produzione di farmaci in siringhe pre-riempite sono gestiti secondo i più elevati standard qualitativi in accordo agli attuali requisiti regolatori in materia di Combination Products.
Questo articolo descrive un recente Case Study di registrazione ed approvazione in USA di un Combination Product in siringhe pre-riempite gestito da Italfarmaco con la collaborazione di PTM Consulting.
* di Marinella Capuzzi*, Lorella Pagliani**, Francesca Speroni**
*Industrial Development Laboratory Manager, Italfarmaco Spa
** Senior Consultant; PTM Consulting Srl a socio unico
Combination Product (CP) è un termine usato in ambito Food & Drug Administration (FDA) per identificare prodotti ove esista una combinazione, ad esempio farmaco/medical device, medical device/prodotto biologico: i Combination Product (CP) possono essere immessi sul mercato come singola entità o presenti separatamente in un unico packaging.
La definizione di Combination Product si trova nel 21 CFR Part 3.2(e) e i requisiti per questi prodotti sono descritti in 21 CFR Part 4 “Regulation of Combination products” che dettaglia i requirements sia in termini di Good Manufacturing Practices (GMP) sia in termini di Post-Marketing Safety Reporting. Inoltre, FDA ha emesso una serie di linee guida che possono essere relative ad argomenti trasversali, ad esempio la usability di questi prodotti, o specifiche per una certa combinazione quali ad esempio gli emergency-use injectors. I Combination Product non hanno per ora un corrispondente normato in ambito europeo, anche se, in seguito all’introduzione del Medical Device Regulation (Reg. 2017/745), i cosiddetti Drug-Device Combination (DDC) cominciano ad essere riconosciuti anche sul suolo EU.
Il Combination Product è un prodotto in cui la combinazione è necessaria in tutte le sue parti per poter raggiungere l’intended use del prodotto: è quindi necessario che non solo i singoli costituenti rispettino i requisiti e le norme applicabili, ma che la combinazione finale dia evidenza, nella sua totalità, di soddisfare i requisiti in termini di qualità, sicurezza e performance. Questa necessità si riflette anche nel Sistema di Qualità dell’azienda che produce il CP stesso: è necessario integrare con nuovi approcci il Sistema di Qualità esistente al fine di assicurare che lo sviluppo e la produzione del CP finito siano gestiti in accordo ai principi descritti nel 21 CFR Part 4 e nella Guidance For Industry and FDA Staff “Current Good Manufacturing Practice Requirements for Combination Products”.
Il Sistema di Qualità del titolare del prodotto finito destinato al mercato deve essere opportunamente integrato secondo gli approcci streamlined. In particolare, per un’azienda farmaceutica che integra un device constituent in un prodotto farmaceutico (es. una siringa pre-riempita) è fondamentale rivalutare lo sviluppo del prodotto rispettando i requisiti del Design Control (21 CFR 820.30) per dare evidenza oggettiva che il prodotto sia stato disegnato conformemente al suo scopo d’uso.
Le siringhe pre-riempite (PFS) sono classificabili come Single-Entity Combination Products. Infatti, farmaci in siringhe pre-riempite sono costituiti da due o più componenti regolamentati (drug/device) che sono fisicamente e chimicamente combinati e prodotti come un’unica entità (Figura 1). Nella PFS ciascun componente contribuisce ad un modo di azione della combinazione: I) azione di somministrazione per iniezione attraverso la siringa (device) e II) azione farmacologica attraverso la formulazione (drug). La siringa viene quindi definita device constituent part (DCP) della combinazione.
Nell’ambito dello sviluppo di un farmaco in PFS è richiesta l’implementazione del Design and Development plan che indichi ruoli e responsabilità nelle varie fasi. Il piano per il disegno ed il processo di sviluppo di un prodotto in siringhe-preriempite ha lo scopo di assicurare un approccio comune per lo sviluppo e coerente con il Design Control, mediante criteri che gestiscono le fasi sequenziali di Feasibility, Full Development, Product Validation e Design Transfer.
Per la registrazione del prodotto per il mercato USA, Italfarmaco ha applicato i principi del Design Control (Figura 2), in particolare al processo di sviluppo del device.
E’ stata quindi implementata una sequenza logica di fasi finalizzate ad assicurare che il device somministrasse adeguatamente il farmaco e che la qualità del farmaco non fosse inficiata negativamente dalla sua interazione con il device.
Intended use / user need. Il farmaco generico in PFS è stato sviluppato con la stessa composizione qualitativa e quantitativa del Reference Listed Drug (RLD). Le indicazioni terapeutiche, le informazioni per il paziente e le istruzioni d’uso per la somministrazione parenterale subcutanea sono state proposte identiche a quelle dell’RLD.
Design Input. I requisiti di Design Input del farmaco generico in PFS si sono basati sui requisiti del prodotto necessari per la per la somministrazione (user requirements), sulle caratteristiche tecniche e funzionali del device (performance requirements) e sulle caratteristiche di sicurezza del device (safety requirements).
Design Identification. Trattandosi di un prodotto di combinazione generico, la strategia adottata per la selezione delle parti costituenti il device (siringa, pistone ed astina) non ha implicato lo sviluppo ex novo dei costituenti, bensì si è basata sull’acquisto dei materiali di packaging disponibili sul mercato (off-the-shelf components), già certificati e registrati dal produttore per farmaci iniettabili in siringhe pre-riempite ad uso umano.
Design Output. Il design output delle parti costituenti il device commercialmente disponibili dai fornitori è consistito nelle fasi di acquisizione e verifica di disegni tecnici, specifiche e dichiarazioni di conformità.
Design Verification / Validation. La fase di Design Verification / Validation del prodotto di combinazione ha avuto lo scopo di confermare con evidenza oggettiva che: il drug/device finale soddisfacesse lo scopo d’uso e le necessità del paziente e che il Design Output soddisfacesse i requisiti definiti nella fase di Design Input. La verifica dei requisiti di performance e safety del Combination Product è stata effettuata mediante analisi chimico-fisica e microbiologica dei lotti industriali di PFS prodotti a scopo registrativo secondo il processo di produzione proposto per i lotti commerciali. I risultati analitici sono stati valutati rispetto al Design Input del device e alle Specifiche di qualità del farmaco. La verifica della conformità all’intended use rispetto alla usability da parte del paziente è stata effettuata in accordo alla linea guida “Comparative Analyses and Related Comparative Use Human Factors Studies for a Drug-Device Combination Product Submitted in an ANDA: Draft Guidance for Industry”.
Design Transfer. Il Design Transfer rappresenta il “ponte” tra la progettazione del prodotto nella fase di pre-market ed il processo di produzione del farmaco commerciale. Durante la produzione dei primi lotti di PFS fabbricati ad uso commerciale è stato necessario un efficace trasferimento del Design Specifications integrato nel Sistema di qualità aziendale e da esso controllato.
Design History File (DHF). Infine, il Design Control è stato documentato in ogni step nel Design History File che referenzia i dati di sviluppo del Combination Product e costituisce il documento GMP principale da presentare nelle registrazioni del farmaco ed ispezionabile onsite su richiesta.
Lo sviluppo di un Combination Product in PFS gestito da Italfarmaco secondo i principi di Design Control ha richiesto un importante contributo interdisciplinare delle funzioni aziendali che si sono intersecate nelle varie fasi di sviluppo fino alla commercializzazione (Sviluppo Farmaceutico, Assicurazione Qualità, Regolatorio, Produzione Farmaceutica, Controllo Qualità). Il case study presentato mette in luce dunque la chiara esigenza dell’integrazione del Design Control nel Sistema di Qualità aziendale per assicurare la qualità del farmaco lungo tutta la supply chain. L’approvazione del farmaco per il mercato USA ha infine suggellato il nuovo approccio implementato da Italfarmaco.